1.- ¿ Cómo se origina la corriente eléctrica?
- Al principio los griegos se sorprendían por las reacciones eléctricas que producian algunos animales. El mísmo Aritótoles empezó a describir la capacidad del pez torpedo, el cual para poder alimentarce paralizaba a sus víctimas.
- Recién en el año de 1776, un médico inglés John Walsh descubrió la capacidad de este animal, la cual era de naturaleza eléctrica. El médico inglés, hizo un experimento disecándolo y encontró entre la cabeza y las branquias un órgano extraño. Este órgano fue investigado por el médico ingles, determinando que era el órgano productor de electricidad del animal.
- En 600 A.C los Griegos encontraron que frotando un electrón contra un paño de piel, atraía partículas de la paja.
- Alrededor del año 1600, el Dr. Guillermo Gilbert investigó las reacciones del ámbar y los imanes y fue el primero que registró la palabra 'eléctrica' en un informe sobre la teoría del magnetismo.
- En 1786, Luigui Galvani mediante un experiemento puedo percatar junto con sus discipulos que las patas de las ranas se contraían al sacar chispas de la máquina eléctrica (Galvani la había construido en 1780) y tocar simultáneamente los nervios musculares con el bisturí. Investigando el hecho, Galvani pudo comprobar que la condición característica del fenómeno era un arco conductor formado por dos metales y unido por sus extremidades libres con el nervio o músculo de la rana, dando así un circuito completo.

Experimento de Galvani
- Hacia 1770 el ingeniero francés Charles-Augustin de Coulomb construyó una sensible balanza de torsión y logró demostrar que la ley newtoniana de la razón inversa de los cuadrados rige también la atracción y la repulsión de las masas eléctricas y magnéticas. La primera ley numérica en el vasto campo de los fenómenos eléctricos estaba descubierta.

Citas y Referencias Bibliográficas
1. La corriente Electrica. Consultada el 14 de noviembre del 2006. Disponible en la Web: http://www.astrocosmo.cl/electrom/electrom-03.htm
2. La Electricidad. Visitada el Miercoles 12 de Noviembre del 2006. Disponible en la Web: http://www.geocities.com/kasen667/la_electricidad.html
3. Wikipedia.org. Visitada el Miercoles 12 de Noviembre del 2006. Disponible en la Web: http://es.wikipedia.org/wiki/Electricidad
2.- ¿ Cuáles son las clases de corriente eléctrica?
DEFINICIÓN DE CORRIENTE ELECTRICA
La corriente eletrica es la circulación de cargas o electrones a través de un circuito eléctrico cerrado, que se mueven siempre del polo negativo al polo positivo de la fuente de suministro de fuerza electromotriz (FEM).

CLASES DE CORRIENTE ELECTRICA
Los dos tipos de corrientes eléctricas más comunes son: corriente directa o continua (CD) y corriente alterna (CA).
* Corriente Continua:
- La corriente cuntinua es aquella que no presenta variación ni en magnitud ni en sentido. Mayormente en las instalaciones o en casas residenciales, su uso es limitado en casos específicos.

- Siempre en un solo sentido, es decir, del polo negativo al positivo de la fuente de fuerza electromotriz (FEM) que la suministra.
- Esa corriente mantiene siempre fija su polaridad, como es el caso de las pilas, baterías y dinamos.

* Corriente Alterna:
- Esta corriente se diferencia de la directa en que cambia su sentido de circulación periódicamente y, por tanto, su polaridad. - Esto ocurre tantas veces como frecuencia en hertz (Hz) tenga esa corriente .
- La corriente alterna es el tipo de corriente más empleado en la industria y es también la que consumimos en nuestros hogares.
- La corriente alterna de uso doméstico e industrial cambia su polaridad o sentido de circulación 50 ó 60 veces por segundo, según el país de que se trate. Esto se conoce como frecuencia de la corriente alterna.
- Este tipo de corriente es la que nos llega a nuestras casas y la usamos para alimentar la TV, el equipo de sonido, la lavadora, la refrigeradora, etc.

Citas y Referencias Bibliográficas1. Monografías. Nociones Fundamentales de la electricidad. Visitada el Miercoles 12 de Noviembre del 2006: http://www.unicrom.com/Tut_la_corriente_alterna__.asp
3. Monografías. Visitada el Miercoles 12 de Noviembre del 2006. Disponible en la Web: http://www.monografias.com/trabajos10/nofu/nofu.shtml
4. Wikipedia. Visitada el Miercoles 12 de Noviembre del 2006. Disponible en la Web: http://es.wikipedia.org/wiki/Corriente_continua
3.- ¿ Cuáles son los elementos de la electrólisis?
* DEFINICIÓN DE LA ELECTROLISIS: La electrólisis es un proceso donde la energía eléctrica cambiará a energía química. El proceso sucede en un electrólito, una solución acuosa o sales disueltas que den la posibilidad a los iones ser transferidos entre dos electrodos. El electrolito es la conexión entre los dos electrodos que también están conectados con una corriente directa. Esta unidad se llama célula de electrolisis.
* ELEMENTOS DE LA ELECTROLISIS:
- EL electrolito: es una sustancia que disocia iones libres cuando se disuelve( o funde), para producir un medio que conduce la electricidad. Dado que generalmente consisten de iones en una solucion, a los electrolitos se les llama tambien solutos ionicos.

- Los electrodos: Son conductores que actúan como contacto entre la disolución o la sal fundida y un circuito externo en una celda electroquímica, la reacción tiene lugar en ambos electrodos

- La celda electrolítica: Es un dispositivo simple de dos electrodos, sumergido en un electrolito capaz de originar energía eléctrica por medio de una reacción química. Si se produce una reacción química por el paso de electricidad a través de ella, tenemos las celdas electrolíticas. Cuando se combinan dos o mas celdas en serie o paralelo se obtiene una batería. El acumulador de plomo es una batería constituida por tres celdas conectadas en serie.

Citas y Referencias Bibliográficas
1. Reservados todos los derechos. Visitada el Miercoles 12 de Noviembre del 2006. Disponible en la Web: http://www.uc.cl/quimica/agua/glos2.htm
2. Reservados todos los derechos. Visitada el Miercoles 12 de Noviembre del 2006. Disponible en la Web: es.wikipedia.org/wiki/Electrolito
3. Reservados todos los derechos. Visitada el Miercoles 12 de Noviembre del 2006. Disponible en la Web: http://html.rincondelvago.com/electrolisis_2.html
4.- Investigadores y científicos que han aportado al estudio y desarrollo de la electricidad.
Investigadores y científicos que han aportado al estudio y desarrollo de la electricidad |
Thales de Miletus | Afirmó que al frotar el ámbar, dota un poder de atracción de algunos objetos. |
Theophrastus | Hizo el primer estudio científico de la electricidad. |
William Gilbert | Trabajó hacer la base principal para la definición de los fundamentos de la Electrostática y Magnetismo y fue el primero en aplicar el termino electricidad del griego "ELEKTRON" = Ambar. |
Benjamín Franklin | Demostró la naturaleza de eléctrica de los rayos. Desarrolló la teoría de que la electricidad es un fluido que existe en la materia y su flujo se debe al exceso o defecto del mismo en ella. Invento el "Pararrayos” y los “lentes Bifocales". |
Coulomb | Inventó la balanza de torsión con la que midió con exactitud la fuerza entre las cargas eléctricas y corroboró que dicha fuerza era proporcional al producto de las cargas individuales e inversamente proporcionales al cuadrado de la distancia que las separa. |
Alejandro Volta | Construye la primera celda Electrostática y la batería capaz de producir corriente eléctrica, el cual fue inspirado por Luigi Galvani. |
Luigi Galvani | Propuso la teoría de la Electricidad Animal, lo cual contrarió a Volta, quien creía que las contracciones musculares eran el resultado del contacto de los dos metales con el músculo. Sus investigaciones posteriores le permitieron elaborar una celda química capaz de producir corriente continua, fue así como desarrollo la Pila. |











Investigadores y científicos que han aportado al estudio y desarrollo de la electricidad |
Humphry Davy | - Desarrolla la electroquímica explorando el uso de la pila de Volta o batería, y tratando de entender como ésta funciona. - 1801 observa el arco eléctrico y la incandescencia en un conductor energizado con una batería. - 1806 y 1808 publica el resultado de sus investigaciones sobre la electrólisis, donde logra la separación del Magnesio, Bario, Estroncio, Calcio, Sodio, Potasio y Boro. - En 1807 fabrica una pila con más de 2000 placas doble, con la cual descubre el Cloro y demuestra que es un elemento, en vez de un ácido. - En 1815 inventa la lámpara de seguridad para los mineros.
- Sin ningún lugar a duda, el descubrimiento más importante fue cuando descubre al joven Michael Faraday y lo toma como asistente.
|
Danés Hans Christian Oersted | Descubre el electromagnetismo, cuando en un experimento para sus estudiantes, la aguja de la brújula colocada accidentalmente cerca de un cable energizado por una pila voltaica, se movió. Esto fue crucial en el desarrollo de la Electricidad, ya que puso en evidencia la relación existente entre la electricidad y el magnetismo.
|
Andre-Marie Ampere | Establece los principios de la electrodinámica, cuando llega a la conclusión de que la Fuerza Electromotriz es producto de dos efectos: La tensión eléctrica y la corriente eléctrica. Experimenta con conductores, determinando que estos se atraen si las corrientes fluyen en la misma dirección, y se repelen cuando fluyen en contra. |
Georg Simon Ohm | Fue quien formuló con exactitud la ley de las corrientes eléctricas, definiendo la relación exacta entre la tensión y la corriente. Desde entonces, esta ley se conoce como la ley de Ohm.
|
Michael Faraday
| A los 14 años trabajaba como encuadernador, lo cual le permitió tener el tiempo necesario para leer y desarrollar su interés por la Física y Química. A pesar de su baja preparación formal, dio un paso fundamental en el desarrollo de la electricidad al establecer que el magnetismo produce electricidad a través del movimiento.
|
Simule Morse
| Mientras regresaba de uno de sus viajes, concibe la idea de un simple circuito electromagnético para transmitir información: El Telégrafo. |
Citas y Referencias Bibliográficas
1. Wanadoo.com. Historia de la electricidad. Personajes históricos. Visitada el 15/11/06. Disponible en la web: /http://html.rincondelvago.com/historia-de-la-electricidad_1.html
2. Batteries in a portable world. Historia del desarollo de la bateria. Visitada el 17/11/06. Disponible en la web: http://www.buchmann.ca/article3-page2-spanish.asp
5.- ¿ Qué es la electroquímica?
* Es una rama de la química que estudia las reacciones que toman lugar en la interfase de un conductor electrónico (Donde el electrodo está compuesto de un metal o un semiconductor, incluyendo el grafito) y un conductor iónico (el electrolito).
* En otras palabras trata sobre la relación entre corrientes eléctricas y las reacciones químicas, y de la conversión de la energía química en eléctrica. . En un sentido más amplio, la electroquímica es el estudio de las reacciones químicas que producen efectos eléctricos y de los fenómenos químicos causados por la acción de las corrientes o voltajes.

Citas y Referencias Bibliográficas
1. Wikipedia. Electroquímica. Consultada el 15 de noviembre del 2006. Disponible en la Web: http://es.wikipedia.org/wiki/ElectroquÃmica
2. Electroquímica. Consultada el 15 de noviembre del 2006. Disponible en la Web: http://es.encarta.msn.com/encyclopedia_761569809/ElectroquÃmica.html
6.- Unidades electoquímicas
Dentro de las unidades electroquímicas encontramos las siguientes:
- Amperios (A): Intensidad de una corriente que pasa por un conductor.
- Voltios (V): Diferencia potencial en los puntos extremos de un conductor.
- Coulomb (COUL): Cantidad de energía transportada.
- Faraday (F): Otra unidad de cantidad de energía que se emplea con frecuencia, equivale a 96500 coulomb.
Citas y Referencias Bibliográficas
1. Rincón del vago. Unidades y Ecuaciones Fundamentales. Consultada el 15 de noviembre de 2006. http://html.rincondelvago.com/electrolisis_3.html
7.-.- Describe las leyes de la electroquímica
1) La cantidad de electrones (electricidad) que circulan por un conductor se mide en Coulomb.
q = carga --> [q] = coulomb
2) La intensidad de la corriente (caudal de electrones) expresa la cantidad de electricidad que circula por un conductor por unidad de tiempo. La intensidad de la corriente se mide en Amperes.
i = q/t Þ q = i.t --> [i] = A
3) Cuando una fuente fuerza a los electrones a circular por un conductor, se presenta una resistencia al flujo de corriente y se produce una caída de potencial. La resistencia eléctrica se mide en Ohms,y la diferencia de potencial en Voltios.
E = i.R --> [E] = V y [R] = ohm
* Primera Ley de Faraday: La masa de un elemento depositada en un electrodo es proporcional a la cantidad de electricidad que pasa a través de la solución del electrólito o del electrólito fundido.
m = ζ.i.t
donde # es una constante que depende del catión y se denomina equivalente electroquímico. Cuando se realiza, por ejemplo, la electrólisis de una solución de sulfato cúprico (CuSO4), vemos los siguiente:

Cu2SO4 + H2O --> Cu++ + SO4= + H+ + HO-
* Segunda Ley de Faraday: Las masas de elementos que se depositan en los electrodos son proporcionales a los equivalentes químicos.
Recordemos que el equivalente químico de un elemento es el cociente entre el peso atómico gramo de ese elemento y su valencia:
Eq = Pa/V
Para probar esta segunda ley se hace pasar la misma cantidad de electricidad a través de varias cubas con diferentes soluciones salinas, como indica la figura. Midiendo la cantidad de plata y de cobre depositados en el cátodo se llega a la comprobación de la ley:
m Ag+ / m Cu++ = Eq Ag/ Eq Cu
m Ag+ / m Cu++ = 107,8/31,75
O sea que las masas de plata y de cobre depositadas en los electrodos se hallan en relación de: 107,8 /31,75.

Citas y Referencias Bibliográficas
1. Rincon del vago. Electroquímica. Leyes de la electrolisis. Consultada el 15 de noviembre de 2006. Disponible en la Web: http://www.fisicanet.com.ar/quimica/electrolisis/ap01_electrolisis.php
8.- Básicamente, grafica y explica las partes de una batería o pila desde la física y la química.
PARTES DE LA BATERIA O PILA:
La batería es la parte encargada de almacenar la corriente necesaria para el funcionamiento del automovil.
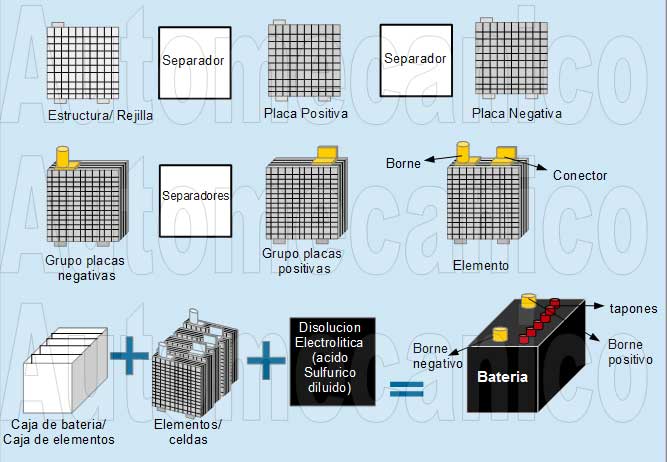
Todas las baterias tienen un determinado número de celdas que acumulan más de dos voltios. Las baterías de automovil tienen 6 celdas.
* Composición Física:
- La celda de plomo: se compone de cierta cantidad de placas negativas y positivas. Las placas positivas y las negativas se diferencian por la forma de los entretejidos y el tipo del material activo. El color del negativo es gris y el positivo es café.
- Las placas: están llenas de ácido para acumuladores que se compone de 37,5% de ácido sulfúrico concentrado y agua destilada (H20).
* Composición Química:
- Zinc/Carbono: son las pilas llamadas comunes o especiales para linterna, contienen muy poco Mercurio, menos del 0,01%. Esta compuesta por Carbono, Zinc, Dióxido de Manganeso y
- Cloruro de Amoníaco. Puede contaminar 3.000 litros de agua por unidad.
- Alcalinas (Manganeso): son mas recientes que las anteriores. Su principio activo es un compuesto alcalino (Hidróxido Potasio). Su duración es 6 veces mayor que las Zinc/Carbono. Esta compuesta por Dióxido de Manganeso, Hidróxido de Potasio, pasta de Zinc amalgamada con Mercurio (total 1%), Carbón o Grafito. Una sola pila alcalina puede contaminar 175.000 litros de agua (mas de lo que puede consumir un hombre en toda su vida).
- Mercurio: Fue la primer pila que se construyo del tipo micropila o botón. Exteriormente se construyen de acero y consta de un electrodo de Oxido de Mercurio con polvo de Grafito, el electrolito esta compuesto de Hidróxido de Potasio embebido en un material esponjoso absorbente y pasta de Zinc disuelto en Mercurio. Contiene entre un 25 y un 30% de Mercurio. Esta micropila puede contaminar 600.000 litros de agua.
- Níquel/Cadmio: Esta pila tiene la forma de la pila clásica o alcalina, pero tiene la ventaja que se puede recargar muchas veces. Esta constituida por Níquel laminado y Cadmio separado por nylon o polipropileno, todo arrollado en espiral. No contiene Mercurio. Sus residuos son peligrosos para el medio ambiente, principalmente por la presencia del Cadmio.
Partes de la Pila
Etiqueta

Vaso de Acero

Cátodo

Papel Separador

Ánodo

Electrolito

Colector

Sello

Cubierta positiva

Cubierta Negativa

Citas y Referencias Bibliográficas
1. Bateria. Acumulador/Pilas parte 2. Consultada el 16 de noviembre del 2006. Disponible en la Web: http://www.automecanico.com/auto2001/Bateria1.html
2. Descripción de las partes de una batería. Consultada el 16 de novienmbre del 2006. http://www.superservicio.co.cr/pagecreator/paginas/batteries.htm
9.- En una pila o batería, hay compuestos que reaccionan. Explica y escribe las ecuaciones que suceden.
* Reacciones reducción- oxidación

ECUACIONES QUE SUCEDEN:
* Durante la descarga se invierten los procesos de la carga. El óxido de plomo(IV) es reducido a sulfato de plomo (II) mientras que el plomo elemental es oxidado para dar igualmente sulfato de plomo (II). Los electrones intercambiados se aprovechan en forma de corriente eléctrica por un circuito externo. Se trata por lo tanto de una conmutación. Los procesos elementales que trascurren son los siguientes:
PbO2 + 2 H2SO4 + 2 e- -> 2 H2O + PbSO4 + SO42-
Pb + SO42- -> PbSO4 + 2 e-
El voltaje de una pila alcalina es cercano a 1,5 v. Durante la descarga, las reacciones en la celda seca alcalina son :
Ánodo: Zn(S) + 2 OH- (ac) -->Zn(OH)2(s) +2 e-
Cátodo: 2 MnO2 (S) + 2 H2 O (l) + 2 e- -->2MnO (OH) (s) + 2 OH-(ac)
Global: Zn(s) +2 MnO2 (s) 2H2O(l) --> Zn(OH)2(ac) + 2MnO (OH) (s)
Citas y Referencias Bibliográficas
1. Mátrix: Un mundo que funciona con pilas. Consultada el 16 de noviembre de 2006. Disponible en la web: http://www.cienciateca.com/MatrixPilas.html
2. Batería Electrica. Batería alcalina. Consultada el 17 de noviembre del 2006. Disponible en la Web: http://es.wikipedia.org/wiki/Bater%C3%ADa_el%C3%A9ctrica
10.- En nuestro cuerpo, ¿existe corriente eléctrica: ¿Cómo se presenta? ¿Dónde es más notoria?
Sabemos que nuestro cuerpo funciona mediante impulsos eléctricos. Podemos comprobar que algunos están asociados al funcionamiento de corazón, (ECG), y otros al funcionamiento del cerebro (EEG). Las leyes de la física se aplican como a cualquier otra sustancia material. Cuando una corriente eléctrica circula por un cable, siempre existe un campo electromagnético alrededor. De esto se deduce que existe una corriente eléctrica circulando por nuestro cuerpo con su energía electromagnética asociada. Actualmente se puede visualizar ese campo mediante la fotografía Kirlian.
Los científicos occidentales están investigando mucho en la actualidad estas nuevas ideas sobre Anatomía, Fisiología, Bioquímica, etc. Estos campos energéticos de nuestro cuerpo, controlan numerosas funciones diferentes: mentales, emocionales, etc. En el caso de una salud perfecta, todos los sistemas del cuerpo reciben una información adecuada gracias a una circulación energética correcta; sin embargo, nuestro cuerpo puede estar sometido a un gran stress, no haber una buena circulación energética y por tanto, algo que debe ser corregido.

Citas y Referencias Bibliográficas
1. Desmares y desbarres. Consultada el 15 de noviembre de 2006. Disponible en la web: http://desmadresydesbarres.no-ip.org/index.php?p=87
GLOSARIO
ÁCIDO: Especie química que libera iones hidrógeno, H+. (Definición de Löwry- Brönsted, que en este respecto coincide con la definición clásica de Arrhenius).
ACUMULADOR: Cualquier elemento productor de energía eléctrica basado en una/s pila/s secundaria/s (acumulador equivale a recargable).
AMPERE: Es la intensidad de una corriente eléctrica constante que, mantenida en dos conductores paralelos, rectilíneos, de longitud infinita, de sección circular despreciable y colocados en el vacío a una distancia de un metro uno de otro, produce entre estos dos conductores una fuerza igual a 2 x 10-7 Newton por metro de longitud.
ANIÓN: Ion que posee carga negativa.
ANODO: Electrodo en el que tiene lugar la oxidación en una celda electroquímica.
ATOMOS: Las partículas más pequeñas que poseen las propiedades de un elemento; toda la materia está compuesta de átomos.
AVOGADRO: LEY DE Volúmenes iguales de gases a la misma temperatura y presión contienen el mismo número de moléculas.
BASE: Especie química que capta iones hidrógeno, H+. (Definición de Löwry- Brönsted).
BATERIA: Unidad productora de energía eléctrica constituida por varias pilas.
BOYLE, LEY DE: A presión constante, el producto de la presión y el volumen de una muestra dada de gas es constante.
CAPA DE VALENCIA: Nivel de energía de un átomo que determina sus propiedades químicas, en particular la formación de enlaces.
CATALIZADOR: Sustancia que acelera una reacción química pero no sufre cambios.
CATIÓN: Ion que posee carga positiva.
CÁTODO: En una celda electroquímica, el electrodo en el que tiene lugar la reducción.
CELDA ELECTROQUÍMICA: Dispositivo para llevar a cabo una electrólisis o producir electricidad por medio de una reacción química.
CELDA VOLTAICA: Celda electroquímica en la que se emplea una reacción química espontánea para producir electricidad.
COMPUESTO COVALENTE: Compuesto que contiene sólo enlaces covalentes.
COMPUESTO IÓNICO: Sustancia compuesta por iones.
CONCENTRACIÓN: Cantidad de soluto disuelto en una cantidad específica de disolvente o disolución.
CONDUCTIVIDAD ELÉCTRICA: Capacidad para conducir una corriente eléctrica.
CONDUCTOR: Material que permite que la electricidad fluya.
CONFIGURACIÓN ELECTRÓNICA: Distribución de los electrones en los diversos niveles energéticos de un átomo, ión o molécula.
COULOMB: Es la cantidad de electricidad transportada en 1 segundo por una corriente de 1 ampere.
CHARLES, LEY DE: A presión constante, el volumen de una muestra dada de gas es directamente proporcional a la temperatura kelvin.
CORRIENTE: Flujo de electrones.
DENSIDAD: La masa por unidad de volumen de un material dado.
DISOLUCIÓN AMORTIGUADORA: Solución que contiene un ácido o base débil y una de sus sales, que tiene la propiedad de mantener el pH dentro de un estrecho rango cuando se le adicionan cantidades discretas de ácidos o bases. Se les llama también disoluciones “buffer” o tampón.
ECUACIÓN IÓNICA NETA: Ecuación que muestra solamente las sustancias químicas que participan en una reacción en la que intervienen iones en disolución acuosa.
ECUACIÓN QUÍMICA: Combinación de fórmulas químicas que representa lo que ocurre en una reacción química, por ejemplo, 2 H2(g) + 02(g) = 2H20(g).
ELECTROAFINIDAD: Es la energía asociada a la captación de un electrón por la capa de valencia de un átomo. Se le asigna arbitrariamente un signo algebraico contrario al convencional.
ELECTRODOS: Dos tiras de metal o de otros conductores, que actúan como contactos entre la disolución o la sal fundida y el circuito externo en una celda electroquímica; la reacción tiene lugar en ambos electrodos.
ELECTRÓFILO: Especie que presenta alguna deficiencia de electrones o que tiene carga positiva y que se enlaza a átomos, particularmente carbono, en especies de alta densidad de carga electrónica o con carga negativa.
ELECTROLITO: El electrolito de una pila puede ser un líquido o una pasta en el primer caso, la cera se llama a menudo pila húmeda. Las pilas en la que el electrolito es una pasta se denomina pilas secas.
ELECTRÓN: Partícula con carga negativa, presente en todos los átomos. Partícula fundamental de la materia, tiene una carga negativa de 1,602176462 × 10-19 culombios ± 0,000000063 × 10-19 culombios y una masa de 9,10938188 × 10-31 kg ± 0,00000072 × 10-31 kg.
ELECTRONEGATIVIDAD: Capacidad de un átomo, en una molécula, para atraer los electrones hacia sí.
ELECTRÓLISIS: Uso de la energía eléctrica para hacer que ocurra una reacción de oxidación- reducción no espontánea.
ELEMENTOS: Sustancias químicas fundamentales, de las cuales están formadas todas las demás sustancias.
ENERGÍA CINÉTICA: Energía asociada al movimiento de un objeto.
ENERGÍA DE ACTIVACIÓN: Energía mínima requerida para la colisión fructífera de partículas de reactivos en una reacción química.
ENERGÍA DE ENLACE: Energía necesaria para romper un enlace. Por lo general se refiere a 1 mol de enlaces y se expresa en kJ • mol–1.
ENERGÍA DE IONIZACIÓN: Energía necesaria para desprender un electrón de un átomo aislado, al estado gaseoso. Corresponde a la energía involucrada en el proceso:M M+ + e–
ENLACE COVALENTE: Fuerza que mantiene muy unidos dos átomos, y que se presenta cuando dichos átomos comparten uno o más pares de electrones.
ENLACE IÓNICO: Atracción entre iones con carga opuesta en un compuesto iónico.
ENLACE METÁLICO: Enlace formado por elementos metálicos, que es fuertemente deslocalizado.
ENLACE QUÍMICO: Fuerza que mantiene unidos los átomos o iones en los compuestos químicos.
ESTADO: La forma (gas, líquido o sólido) en la que se halla la materia.
ESTADO GASEOSO: Estado de la materia que no posee volumen o forma fijos.
ESTADO O NÚMERO DE OXIDACIÓN: Se define formalmente, para un átomo en un compuesto binario, como el número de electrones que gana o pierde dicho átomo para formar un compuesto.
ESTEQUIOMETRÍA: Proporción en que los elementos o compuestos reaccionan entre sí.
ESTRUCTURA DE LEWIS: Representación de los electrones de la capa de valencia de un átomo mediante puntos. Los enlaces covalentes simples entre dos átomos se representan por un par de puntos o por un trazo, los enlaces dobles por dos pares de puntos o por dos trazos y así sucesivamente.
EXOTÉRMICO: Proceso que libera energía.
ENERGÍA INTERNA: Comprende todas las formas de energía de un sistema y se compone de las energías propias de las partículas y de sus interacciones.
ESTADO O NÚMERO DE OXIDACIÓN: Se define formalmente, para un átomo en un compuesto binario, como el número de electrones que gana o pierde dicho átomo para formar un compuesto.
ESTEREOQUÍMICA: Representación de una molécula en el espacio tridimensional, de modo que refleja la real ubicación de sus átomos o grupos atómicos.
FAMILIA (TABLA PERIÓDICA): Columna vertical de elementos en la tabla periódica; también llamada grupo; los miembros de una familia tienen propiedades similares.
FÓRMULA DE ELECTRÓN-PUNTO: Fórmula de una sustancia, en la que puntos que representan los electrones exteriores de cada átomo muestran los pares electrónicos compartidos entre átomos.
FÓRMULA ESTRUCTURAL: Fórmula química que muestra el arreglo de los átomos y los enlaces covalentes en una molécula.
FÓRMULA QUÍMICA: Combinación de símbolos que representa los elementos presentes en una sustancia, y en la que los subíndices muestran el número de átomos de cada elemento; por ejemplo, la fórmula del amoniaco es NH3.
GAS NOBLE: Elemento del grupo 18, He, Ne, Ar, Kr, Xe, Rn. Los gases nobles se caracterizan por sus niveles “np” completos (a excepción del He que completala capa 1s) y son elementos de escasa, pero no nula, reactividad química. Por ello no se deben denominar “gases inertes”.
GRUPO FUNCIONAL: Conjunto de átomos enlazados de una determinada manera, que caracteriza el comportamiento físico-químico de las moléculas que lo contienen. Ejemplos típicos son los grupos funcionales ácido carboxílico, - C(O)OH, alcohol, -OH, y éster, - C(O)O-R.
HIBRIDACIÓN: Combinación algebraica de orbitales atómicos de energía similar, para generar un número equivalente de orbitales “mezclados” o “híbridos”.
HIDRATACIÓN: Fenómeno por el cual un ión o molécula se rodea de moléculas de agua. Para el caso general de cualquier disolvente el proceso se denomina solvatación.
INDICADOR ÁCIDO-BASE: Sustancia que manifiesta un cambio (por lo general de color) a determinado valor de la concentración de iones H+ en la disolución.
ION Átomo o grupo de átomos que ha quedado cargado eléctricamente al perder o ganar electrones.
ION MONOATÓMICO: Especie eléctricamente cargada que consiste de sólo un átomo.
ION POLIATÓMICO: Especie eléctricamente cargada consistente de dos o más átomos.
ISÓMEROS GEOMÉTRICOS: Moléculas con idéntico número de átomos y enlaces, pero con diferente distribución espacial.
ISÓTOPOS: Átomos del mismo elemento pero con distinto número de neutrones.
IRREVERSIBILIDAD: En un sentido no riguroso2 alude a la calidad de procesos (irreversibles) en un sistema que ocurren cuando se alteran las condiciones del entorno, en una dirección pero no en dirección contraria.
LLUVIA ÁCIDA: Precipitación de agua ácida desde las nubes, por formación de ácido sulfúrico y nítrico en la atmósfera.
MASA ATÓMICA: La masa de un átomo.
MASA MOLAR: Masa (por lo general en gramos) de un mol de una sustancia.
MATERIA: Lo que tiene masa y ocupa lugar en el espacio.
MEDIA CELDA: Metal (u otro material que actúa como electrodo) y la disolución de sus iones que lo rodea en una celda voltaica.
MOL: Cantidad de una sustancia o especie química igual a 6.02 x 1023 unidades, las cuales pueden ser átomos, moléculas, unidades de fórmula, electrones u otras entidades específicas.
MOLÉCUL: Partícula más pequeña de una sustancia química que conserva sus covalentes.
MECANISMO DE REACCIÓN: Descripción de una secuencia de eventos que se postula que ocurren a nivel molecular cuando los reactantes se transforman en productos.
MÉTODO DEL ION ELECTRÓN: Procedimiento de igualación que se aplica primero, independientemente, a las ecuaciones de las semi-reacciones de oxidación y de reducción. En una segunda etapa éstas se relacionan para representar la reacción completa de óxido-reducción (o redox), cuidando que el número de electrones cedidos en la semirreacción de oxidación sea igual al número de electrones aceptados en la reducción.
METALES: Elementos de brillo característico, que conducen bien la corriente eléctrica y el calor.
METALOIDE: Elemento con propiedades intermedias a las de los metales y los no metales. Su conductividad eléctrica aumenta al elevar la temperatura.
MÉTODO DEL ION ELECTRÓN: Procedimiento de igualación que se aplica primero, independientemente, a las Ecuaciones de las semi-reacciones de oxidación y de reducción.En una segunda etapa éstas se relacionan para representar la reacción Completa de óxido-reducción (o redox), cuidando que el número de electrones cedidos en la semirreacción de oxidación sea igual al número de electrones aceptados en la reducción.
MODELO PLANETARIO: Modelo que describía al átomo como un diminuto sistema solar, en el que los electrones giraban alrededor del núcleo de manera análoga a como lo hacen los planetas alrededor del sol. Este modelo fue superado ya que no corresponde a una realidad física.
MOLALIDAD: Unidad de concentración de disoluciones que se define como el número de moles de soluto disuelto en 1 kilogramo de solvente.
MOLARIDAD: Unidad de concentración definida por el número de moles de soluto o de especies iónicas en 1 litro de solución.
NEUTRÓN: Partícula neutra presente en los núcleos de la mayoría de los átomos. Localizada en el núcleo atómico de todos los átomos excepto el hidrógeno. Los neutrones no tienen carga eléctrica pero poseen una masa de 1,008665 uma.
NO METAL: Elemento que es mal conductor del calor y de la electricidad.
NÚMERO ATÓMICO: El número de protones de un átomo; permite distinguir los átomos de distintos elementos.
NÚMERO DE MASA: Suma del número de protones y neutrones en un átomo de un isótopo especifico.
NUCLEÓFILO: Especie que presenta un par electrónico no compartido o con carga negativa, que específicamente ataca a un átomo, generalmente de carbono, de una molécula que exhibe baja densidad de carga electrónica o carga positiva.
NÚMERO DE AVOGADRO: 6,0223 • 1023. Es el número de partículas en 1 mol.
ORBITAL: Se puede definir como una región del espacio alrededor del núcleo atómico que puede estar ocupada por 1 ó 2 electrones. (Esta no es una definición rigurosa, ya que el orbital es una función matemática o función de onda característica, que es solución de la ecuación de ondas de Schrödinger. Para el caso de un átomo se designan como orbitales atómicos, mientras que en las moléculas se conocen con el nombre de orbitales moleculares).
OSMOSIS: Paso de moléculas de solvente a través de una membrana semipermeable, que se manifiesta por un flujo neto de solvente desde una solución diluida o desde el solvente puro hacia una solución más concentrada.
OSMOSIS INVERSA: Es el fenómeno inverso al espontáneo de osmosis y se logra aplicando una presión a una solución concentrada de modo que moléculas de solvente pasen a través de una membrana semipermeable hacia otra solución más diluida o hacia el solvente puro.
OXIDOS: Compuestos químico formados por oxígeno y otros elemento.
OXIDACIÓN: Proceso que involucra, formalmente, la cesión de uno o más electrones por parte de un átomo (o un grupo de átomos). Se dice que éste (o éstos) se oxida(n).
PERÍODOS: (TABLA PERIÓDICA) Filas horizontales de elementos en la tabla periódica.
pH: Se define como el valor negativo del exponente de la concentración molar de iones H+ de una disolución, expresada en base 10.
PILAS PRIMARIAS: Pila basada en una reacción química irreversible, y por lo tanto, no recargable (posee un sólo ciclo de vida).
PILAS SECUNDARIAS: Pila basada en una reacción química reversible y, por lo tanto, recargable. Se pueden regenerar sus elementos activos pasando una corriente eléctrica en sentido contrario al de descarga. Posee ciclos de vida múltiples.
PRECISIÓN: Grado de concordancia obtenido en la realización de varias mediciones de una misma cantidad.
POLARIDAD DE ENLACE: Propiedad permanente de un enlace la que se manifiesta por una separación parcial de carga eléctrica determinada por la diferente electronegatividad de los átomos unidos.
PRINCIPIO DE CONSTITUCIÓN DE BOHR: Establece que en la construcción de la estructura electrónica de un átomo los electrones ocupan primero los niveles inferiores de menor energía y, sucesivamente, a medida que éstos se van completando, los niveles superiores de mayor energía. Se le llama también principio de “Aufbau”.
PRINCIPIO DE EXCLUSIÓN DE PAULI: Los electrones siempre ocupan un orbital con espin opuesto, de modo que éste jamás puede ser ocupado por más de dos electrones. (Ello debido a que el número de espin asociado al electrón tiene sólo dos valores posibles y un tercer electrón tendría, necesariamente, su número de espin igual al de alguno de los otros dos).
PRINCIPIO DE MÁXIMA, MULTIPLICIDAD DE HUND: Principio que establece que los electrones en un átomo ocupan varios niveles de idéntica energía de modo tal que su número de espin total, comprendido como la suma de los números de espin de los electrones individuales, es máximo.
PROBABILIDAD: Cociente entre el número de eventos favorables a un determinado suceso y el número total de eventos que pueden ocurrir.
PRODUCTO: Sustancia que se forma en una reacción química.
PRODUCTO IÓNICO DEL AGUA: Producto de las concentraciones molares de iones H+ y OH- y que tiene un valor constante, dependiendo de la temperatura. En rigor depende también de la concentración de sales y/o de la presencia de otros solutos como alcohol.
PROPIEDADES PERIÓDICAS: Propiedades de los átomos de los elementos químicos que se repiten en forma regular o cíclica cuando se representan vs. su número atómico.
PROTÓN: Partícula con carga positiva presente en el núcleo de todos los átomos, se encuentra localizada en el núcleo atómico. Tiene carga positiva igual y de signo opuesto a la del electrón. Los protones tienen una masa de 007276 uma.
PUNTO DE CONGELACIÓN: La temperatura a la que una sustancia pasa del estado líquido al sólido.
PUNTO DE EBULLICIÓN: La temperatura a la que una sustancia pasa del estado líquido al estado gaseoso.
TEORÍA CUÁNTICA: Teoría desarrollada por varios físicos a partir de 1900, año en que Max Planck enuncia su revolucionaria teoría de los cuantos, que explica exitosamente la distribución de energía en una cavidad (cuerpo negro), problema que no tiene una solución si se intenta explicar a través de la física clásica o newtoniana.
RADIO ATÓMICO: En el caso de una molécula diatómica homonuclear, esto es, formada por dos átomos de la misma naturaleza, el radio atómico es la mitad de la distancia que separa los núcleos atómicos.
REACCIÓN QUÍMICA: Cambio en la materia en el que una o más sustancias químicas se transforman en sustancias químicas nuevas o diferentes.
REACCIÓN REVERSIBLE: Reacción química en la que la reacción inversa puede tener lugar de manera simultánea con la reacción directa.
REACTIVO: Sustancia de partida en una reacción química.
REDUCCIÓN: Proceso que significa, formalmente, la captación de uno o más electrones por parte de un átomo o grupo de átomos. Se dice que éste o éstos se reduce(n).
SALES: Compuestos químicos conformados por un catión y un anión, unidos por atracción eléctrica.
SEMIRREACCIÓN: Es un proceso en que imaginariamente transcurre produciéndose en él la oxidación o la reducción de un átomo en una reacción redox.
SISTEMA: Región del universo separado de éste por un borde o límite, real o imaginario.
SISTEMA ABIERTO: Es todo sistema que permite transferencia de masa y energía con el entorno.
SISTEMA AISLADO: Se denomina así a todo sistema que no intercambia materia ni energía con el alrededor.
SISTEMA CERRADO: Un sistema cerrado sólo intercambia energía con el alrededor.
SISTEMA NO REACTIVO: Sistema que respecto de un proceso determinado no sufre transformación química.
SUSTITUCIÓN NUCLEOFÍLICA: Reacción iniciada por un nucleófilo en la que éste reacciona con un sustrato o reactante reemplazando un átomo que es expulsado como anión.
TABLA PERIÓDICA: Tabla en la que los elementos, clasificados en orden de número atómico creciente, se sitúan de manera tal que los que poseen propiedades similares se hallan cerca unos de otros.
TEMPERATURA: Es una variable de estado, que según el modelo cinético-molecular es una medida de la energía cinética o grado de agitación de las moléculas.
UNIDAD DE FÓRMULA: Grupo de átomos o iones representados por la fórmula química de un compuesto; la unidad más sencilla de un compuesto iónico.
UNIDAD DE MASA ATÓMICA(uma): Unidad de masa igual a 1/12 de la masa del núcleo de carbono-12, que es 1,66053873 × 10-27 kg ± 0,00000013 × 10-27 kg. Abreviatura uma.
VOLT: Es la diferencia de potencial eléctrico entre dos puntos de un alambre conductor por el que circula una corriente constante de 1 ampere, cuando la potencia disipada entre sus puntos es de 1 watt.